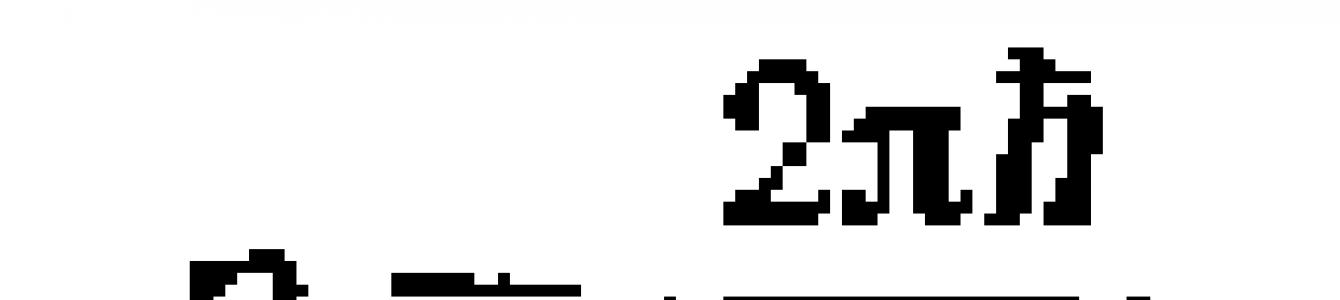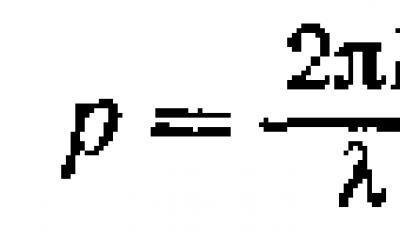Недостаточность теории Бора сделала необходимым критический пересмотр основ квантовой теории и представлений о природе элементарных частиц (электронов, протонов и т. п,). Возник вопрос о том, насколько исчерпывающим является представление электрона в виде малой механической частицы, характеризуемой определенными координатами и определенной скоростью.
В результате углубления наших знаний о природе света выяснилось, что в оптических явлениях обнаруживается своеобразный дуализм (см. § 57). Наряду с такими свойствами света, которые самым непосредственным образом свидетельствуют о его волновой природе (интерференция, дифракция), имеются и другие свойства, столь же непосредственно обнаруживающие его корпускулярную природу (фотоэффект, явление Комп-тона).
В 1924 г. Луи де-Бройль выдвинул смелую гипотезу, что дуалн-зм не является особенностью одних только оптических явлений, но имеет универсальное значение. «В оптике, - писал он, - в течение столетия слишком пренебрегали корпускулярным способом рассмотрения по сравнению с волновым; не делалась ли в теории вещества обратная ошибка?»
Допуская, что частицы вещества наряду с корпускулярными свойствами имеют также и волновые, де-Бройль перенес на случай частиц вещества те же правила пе-
рехода от одной картины к другой, какие справедливы в случае света. Фотон, как известно [см. формулы (57.1) и (57.4)], обладает энергией
и импульсом
По идее де-Бройля, движение электрона или какой-либо другой частицы связано с волновым процессом, длина волны которого равна
а частота
Гипотеза де-Бройля вскоре была блестяще подтверждена экспериментально. Дэвиссон и Джермер обнаружили, что пучок электронов, рассеивающийся от кристаллической пластинки, дает дифракционную картину. Томсон и независимо от него Тартаковский получили дифракционную картину при прохождении электронного пучка через металлическую фольгу. Опыт осуществлялся следующим образом (рис. 190). Пучок электронов, ускоренных разностью потенциалов порядка нескольких десятков киловольт, проходил через тонкую металлическую фольгу и попадал на фотопластинку. Электрон при ударе о фотопластинку оказывает на нее такое же действие, как и фотон. Полученная таким способом электронограмма золота (рис. 191, а) сопоставлена с полученной в аналогичных условиях рентгенограммой алюминия (рис. 191,6). Сходство обеих картин поразительно.
Штерн и его сотрудники показали, что дифракционные явления обнаруживаются также у атомных и молекулярных пучков. Во всех перечисленных случаях


дифракционная картина соответствует длине волны, определяемой соотношением (64.1).
Из описанных опытов с несомненностью вытекает, что пучок микрочастиц определенной скорости и

■аправлеиия дает дифракционную картину, подобную картине, получаемой от плоской волны.
Дифракция электронов - процесс рассеяния электронов на совокупности частиц вещества, при котором электрон проявляет волновые свойства. Данное явление называется корпускулярно-волновым дуализмом , в том смысле, что частица вещества(в данном случае взаимодействующие электроны) может быть описана, как волна.
ДИФРАКЦИЯ НЕЙТРОНОВ - явление рассеяния нейтронов, в к-ром определяющую роль играют волновые свойства нейтрона (см. Корпускулярно-волновой дуализм ).Длина волны и импульс р связаны соотношением де Бройля =hp . Матем. описание Д. н., так же как и в случае др. волновых полей, следует из принципа Гюйгенса - Френеля и, в этом смысле, аналогично описаниюдифракции света , рентг. лучей, электронов и др. микрочастиц (см. Дифракция волн ).Согласно этому описанию, интенсивность рассеянного излучения в некрой точке пространства зависит как от , так и от свойств рассеивающего объекта. Соответственно, Д. н. применяется как для исследования или формирования нейтронных пучков (нейтронные монохроматоры, анализаторы), так и для исследований строения рассеивающего вещества.

Рис. 1. Угловое распределение нейтронов с энергией 14 МэВ, рассеянных на ядре Sn; - сечение рассеяния; - угол рассеяния.
Оценка энергии нулевых колебаний осциллятора. Будем действовать точно так же, как и в предыдущем примере. Энергия классического одномерного гармонического осциллятора описывается выражением
E = px2 / 2m + mω2x2 / 2.
Рассматривая px и х как неопределенности импульса и координаты осциллирующего микрообъекта и пользуясь в качестве соотношения неопределенностей равенством pxх = h, получаем
Е(px) = px2 / 2m + mω2h2 / 2px2 .
Приравнивая к нулю производную, находим величину
р0 = mωh, при которой функция Е(px) принимает минимальное значение. Легко убедится, что это значение равно
Е = Е(p0) = hω.
Этот результат весьма интересен. Он показывает, что в квантовой механике энергия осциллятора не может обратиться в нуль; ее минимальное значение оказывается порядка hω. Это есть так называемая энергия нулевых колебаний.
Учитывая существование нулевых колебаний, можно прийти, в частности, к следующему интересному заключению: энергия колебательного движения атомов кристалла не обращается в не обращается в нуль даже при температуре абсолютного нуля.
Нулевые колебания иллюстрируют принципиальное общее обстоятельство: нельзя реализовать микрообъект на «дне потенциальной ямы», или, иначе говоря, «микрообъект не может упасть на дно потенциальной ямы». Этот вывод не зависит от вида потенциальной ямы, так как является прямым следствием соотношений неопределенности импульса; в этом случае неопределенность координаты должна стать сколь угодно большой, что противоречит самому факту пребывания микрообъекта в потенциальной яме.
Туннелирование электрона через потенциальный барьер является принципиально квантово-механическим эффектом, который не имеет аналога в классической механике. Туннельный эффект является экспериментальным подтверждением одного из фундаментальных исходных положений квантовой механики - корпускулярно-волнового дуализма свойств элементарных частиц.
Туннельным эффектом называется возможность элементарной частице, например электрону, пройти (протуннелировать) через потенциальный барьер, когда барьер выше полной энергии частицы. Возможность существования туннельного эффекта в микромире была понята физиками в период создания квантовой механики, в 20-30-х годах нашего века. В дальнейшем за счет туннельного эффекта были объяснены некоторые весьма важные явления, обнаруженные экспериментально в различных областях физики.
Вопрос 12
А́том (от др.-греч. ἄτομος - неделимый) - частица вещества микроскопических размеров и массы, наименьшая частьхимического элемента , являющаяся носителем его свойств.
Атом состоит из атомного ядра и электронов . Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом . В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам.
Ядро, несущее почти всю (более чем 99,9%) массу атома, состоит из положительно заряженныхпротонов и незаряженныхнейтронов , связанных между собой при помощи сильного взаимодействия . Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в в периодической системе и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N - определённому изотопу этого элемента. Число Z также определяет суммарный положительный электрический заряд (Ze ) атомного ядра и число электронов в нейтральном атоме, задающее его размер.
ВОДОРОДОПОДОБНЫЕ АТОМЫ - атомы (ионы), состоящие, подобно атому водорода, из ядра и одного электрона. К ним относятся ионы элементов с ат. номером 2, потерявшие все электроны, кроме одного: He + , Li +2 , В+ 3 ,. . . Вместе с водородом они образуют простейший изоэлектронный ряд .Уровни энергии (и спектры) В. а. подобны водородным, отличаясь от них масштабом энергий (и частот) переходов в Z 2 раз (см. Атом ).
Системы, подобные В. а., образуют атомное ядро и мезон (мезоатом ),а также электрон и позитрон (позитроний ; )для этих систем также получаются аналогичные водородным уровни энергии и спектры.
Энергетический уровень - собственные значения энергииквантовых систем , то есть систем, состоящих из микрочастиц (электронов , протонов и других элементарных частиц ) и подчиняющихся законам квантовой механики . Каждый уровень характеризуется определённым состоянием системы , или подмножеством таковых в случаевырождения . Понятие применимо к атомам (электронные уровни), молекулам (различные уровни, соответствующие колебаниям и вращениям), атомным ядрам (внутриядерные энергетические уровни) и т.д.
Ионизации и возбуждения.
На освобождение электрона от связи с атомным ядром, вследствие чего и происходит образование положительного иона, необходимо затратить определенное количество энергии. Энергия, израсходованная на отрыв электрона, называется работой ионизации. Работа ионизации, выраженная в электронвольтах, называетсяпотенциалом ионизации (электронвольт-единица энергии, которую приобретает электрон, ускоренный электрическим полем с разностью потенциалов в 1 В). Если сообщить связанному электрону газовой молекулы или атома некоторое количество дополнительной энергии, то электрон перейдет на новую орбиту с более высоким энергетическим уровнем, а молекула или атом будут находиться в возбужденном состоянии. Количество энергии, выраженное в электронвольтах, которое необходимо затратить для возбуждения атома или молекулы газа, называется потенциалом возбуждения. Возбужденное состояние атома или молекулы газа является неустойчивым, и электрон может снова возвратиться на стационарную орбиту, а атом или молекула перейдет в нормальное невозбужденное состояние. Энергия возбуждения при этом передается в окружающее пространство в форме светового электромагнитного излучения.
Величина потенциала ионизации и возбуждения зависит от природы атома. Наименьший потенциал ионизации
(3,9 эВ) имеют пары цезия, а наибольший (24,5 эВ) наблюдается у газа гелия. У щелочноземельных металлов (цезия, калия, натрия, бария, кальция) связь между электронами и ядром невелика, поэтому они имеют наименьшие потенциалы ионизации, следовательно, на возбуждение и работу выхода электрона потребуется затратить меньше энергии, чем у железа, марганца, меди и никеля. Элементы, имеющие меньшие потенциалы ионизации и возбуждения, чем свариваемый металл, вводят в состав электродных покрытий, чтобы повысить стабилизацию дугового разряда в газах. Количество энергии, которое необходимо для выделения электрона из металла или жидкого тела, называется работой выхода электрона и выражается в электронвольтах.
Пространственное распределение электрона в атоме водорода. @
Графически вероятность нахождения электрона можно изобразить в виде облака, где более темные области соответствуют большей вероятности нахождения. «Размеры» и «форму» электронного облака в заданном состоянии атома можно вычислить. Для основного состояния атома водорода решение уравнения Шредингера дает , (2.6)
, (2.6)
где φ
(r)
– волновая функция, зависящая только от расстояния r до центра атома, r 1 – постоянная, совпадающая с радиусом первой Боровской орбиты. Следовательно, электронное облако в основном состоянии водорода сферически-симметрично, как показано на рисунке 11. Электронное облако только приблизительно характеризует размеры атома и движение электрона, так как согласно (2.15) вероятность обнаружения электрона не равна нулю для любой точки пространства. На рисунке 12 изображены электронные облака атома водорода в состояниях: n=2, l=1 и m=1, 0, -1 при наличии магнитного поля.

Рис. 11. Электронное облако атома водорода в основном состоянии n =1, l= 0.

Рис. 12. Электронные облака атома водорода и прецессия моментов импульса в состояниях n = 2, l = 1 для m = 1, 0, -1
Если в этих состояниях определить наиболее вероятные расстояния электрона от ядра, то они будут равны радиусам соответствующих Боровских орбит. Таким образом, хотя квантовая механика не использует представление о движении электрона по определенным траекториям, тем не менее, радиусам Боровских орбит и в этой теории можно придать определенный физический смысл.
ШИРИНА УРОВНЯ - неопределённость энергии кванто-вомеханич. системы (атома, молекулы и др.), обладающей дискретными уровнями энергии в состоянии, к-рое не является строго стационарным. Ш. у. D , характеризующая размытие уровня энергии, его уширение, зависит от ср. длительности пребывания системы в данном состоянии- времени жизни на уровне t k и, согласно неопределённостей соотношению для энергии и времени, Для строго стационарного состояния системы t k = и D =0. Время жизни t k , а следовательно, и Ш.у. обусловлены возможностью квантовых переходов системы в состояния с др. энергиями. Для свободной системы (напр., для изолир. атома) спонтанные излучат. переходы с уровня на нижележащие уровни определяют радиационную, или естественную, Ш.у.:
![]() , где -полная вероятность спон танного испускания с уровня , A ki
- Эйнштейна коэффициентыдля
спонтанного испускания. Уширение уровня может быть вызвано также спонтанными безызлучат. переходами, напр. для радиоакт. атомного ядра - альфа-распадом
.Ширина атомного уровня очень мала по сравнению с энергией уровня. В др. случаях (напр., для возбуждённых ядер, вероятность квантовых переходов к-рых обусловлена испусканием нейтронов и очень велика) Ш.у. может стать сравнимой с расстоянием между уровнями. Любые взаимодействия, увеличивающие вероятность перехода системы в др. состояния, приводят к дополнит. уширению уровней. Примером может служить уширение уровней атома (иона) в плазме
в результате его столкновения с ионами и электронами (см. Излучение плазмы
)
. В общем случае полная Ш.у. пропорц. сумме вероятностей всех возможных переходов с этого уровня - спонтанных и вызванных разл. взаимодействиями.
, где -полная вероятность спон танного испускания с уровня , A ki
- Эйнштейна коэффициентыдля
спонтанного испускания. Уширение уровня может быть вызвано также спонтанными безызлучат. переходами, напр. для радиоакт. атомного ядра - альфа-распадом
.Ширина атомного уровня очень мала по сравнению с энергией уровня. В др. случаях (напр., для возбуждённых ядер, вероятность квантовых переходов к-рых обусловлена испусканием нейтронов и очень велика) Ш.у. может стать сравнимой с расстоянием между уровнями. Любые взаимодействия, увеличивающие вероятность перехода системы в др. состояния, приводят к дополнит. уширению уровней. Примером может служить уширение уровней атома (иона) в плазме
в результате его столкновения с ионами и электронами (см. Излучение плазмы
)
. В общем случае полная Ш.у. пропорц. сумме вероятностей всех возможных переходов с этого уровня - спонтанных и вызванных разл. взаимодействиями.
Особенности структуры электронных уровней в сложных атомах. Связь распределения электронов по орбиталям с периодической таблицей Менделеева.@
Условно все возможные квантовые состояния распределяют (группируют) по слоям (оболочкам), подслоям (подоболочкам) и орбиталям. Как оказалось, свойства атомов определяются распределением электронов по этим состояниям.
Квантовым слоем (квантовой оболочкой) называют совокупность состояний, которым соответствует одно и тем же значение квантового числа n, но разные значения l,m, s. Наибольшее число электронов N, которые могут находиться в оболочке, согласно (2.8), равно удвоенному квадрату номера слоя: N=2n 2 . Так как энергия состояний в многоэлектронном атоме зависит от двух квантовых чисел n и l, то электроны в квантовом слое могут занимать l энергетических уровней. Квантовые слои обозначаются цифрами, соответствующими номерам слоев, кроме того они имеют названия: слой n = 1 называют К слоем (или К оболочкой), слой n = 2 называют L слоем (или L оболочкой), слой n= 3 – М слоем, n = 4 – N, n = 5 – О слоем, n = 6 – Р и так далее.
Каждый квантовый слой с номером n условно состоит из n квантовых подслоев (подоболочек), соответствующих состояниям с одними и теми же n, l, но разными m, s.В подслое может находиться до 2(2l+1) электронов, подслои обозначаются буквами: l = 0 – s, l= 1 – p, l= 2 – d, l= 3 – f, l= 4 – g и т.д. Энергия электронов одного подслоя примерно одинакова.
В свою очередь, каждый подслой состоит из 2l+1орбиталей, соответствующих состояниям с одними и теми же n, l, m, но разными s . 1/2.±На каждой орбитали может находиться не более двух электронов с разными спиновыми числами s =
Отсюда следует, что в s-подслое может содержаться максимум 2 электрона, в р-подслое – 6, в d – 10, в f – 14, в g – 18 электронов. Соответственно в слое K может содержаться максимум 2 электрона, в слое L – 8, в слое M –18, в слое N – 32 и т.д.
1s®Структуры и максимально возможные заполнения слоев изображают в виде формул: K-слой 2 2s®, L слой 2 2p 6 3s®, M-слой 2 3p 6 3d 10 4s®, N-слой 2 4p 6 4d 10 4f 14 . Используя введенные понятия, можно условно формулой и графически изобразить распределение электронов, например атома кислорода О 8 , следующим образом: символьно- 1s 2 2s 2 2p 4 , графически- (Рис.14).

Рис.14. Условное графическое изображение орбиталей кислорода.
При заселении орбиталей электроны в первую очередь располагаются поодиночке на каждой орбитали, а затем начинается их заполнение вторыми электронами. Эта особенность называется правилом Гунда, она связана с тем, что энергия подслоя при таком заполнении несколько меньше. На рис.14 показано применение этого правила для кислорода.
Принцип Паули - фундаментальный закон природы,согласно которому в квантовой системе две (или более) тождественныечастицы с полуцелым спином не могут одновременно находиться в одном и томже состоянии. Сформулирован В. Паули (1925).
Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
1. Главное квантовое число n (n = 1, 2 ...).
2. Орбитальное (азимутальное) квантовое число l (l = 0, 1, 2, ... n-1).
3. Магнитное квантовое число m (m = 0, +/-1, +/-2, +/-... +/-l).
4. Спиновое квантовое число ms (ms = +/-1/2).
Для одного фиксированного значения главного квантового числа n существует 2n2 различных квантовых состояний электрона.
Один из законов квантовой механики, называемый принципом Паули, утверждает:
В одном и том же атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел, (т.е. не может быть двух электронов в одинаковом состоянии).
Принцип Паули дает объяснение периодической повторяемости свойств атома, т.е. периодической системе элементов Менделеева.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовыхсостояниях, каждому из которых соответствует определенная энергия E n . В стационарных состояниях атом не излучает.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней , каждый из которых соответствует определенному стационарному состоянию (рис. 6.2.2). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии E n < 0. При E n ≥ 0 электрон удаляется от ядра, т. е. происходит ионизация. Величина |E 1 | называется энергией ионизации . Состояние с энергией E 1 называется основным состоянием атома.
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией E n в другое стационарное состояние с энергией E m излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
Второй постулат Бора также противоречит электродинамике Максвелла , так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона.
Теория Бора при описании поведения атомных систем не отвергла полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра. Классическая ядерная модель атома Резерфорда в теории Бора была дополнена идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической .
ЛИНЕЙЧАТЫЕ СПЕКТРЫ - оптические спектры испускания и поглощения, состоящие из отдельных спектральных линий. Л. с. являются атомные спектры, спектры звёздных атмосфер (см. Фраунгофероеы линии), спектры органич. молекул при низких темп pax в спец. условиях (см.…
АТОМНЫЕ СПЕКТРЫ - оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров). Обусловлены квантовыми переходами атома. Атомные спектры - линейчатые, состоят из отдельных спектральных линий, которые характеризуются определенной длиной волны и для простых атомов группируются в спектральные серии . Содержат информацию о строении атомов, используются также в спектральном анализе.
Вопрос 13.
ЯДРО АТОМНОЕ - центральная массивная часть атома, состоящая из протонов и нейтронов (нуклонов). В Я. а. сосредоточена почти вся масса атома (более 99,95%). Размеры ядер порядка 10 -13 -10 -12 см. Ядра имеют положит. электрич.заряд , кратный абс. величине заряда электрона е: Q = Ze . Целое число Z совпадает с порядковым номером элемента впериодической системе элементов . Я. а. было открыто Э. Резерфордом (Е. Rutherford) в 1911 в опытах по рассеянию a-частиц при прохождении их через вещество.
СТРОЕНИЕ
Ядро представляет собой центральную часть атома. В нем сосредоточены положительный электрический заряд и основная часть массы атома; по сравнению с радиусом электронных орбит размеры ядра чрезвычайно малы: 10-15 - 10-14 м. Ядра всех атомов состоят из протонов и нейтронов, имеющих почти одинаковую массу, но лишь протон несет электрический заряд. Полное число протонов называется атомным номером Z атома, который совпадает с числом электронов в нейтральном атоме. Ядерные частицы (протоны и нейтроны), называемые нуклонами, удерживаются вместе очень большими силами; по своей природе эти силы не могут быть ни электрическими, ни гравитационными, а по величине они на много порядков превышают силы, связывающие электроны с ядром. Первое представление об истинных размерах ядра давали опыты Резерфорда по рассеянию альфа-частиц в тонких металлических фольгах. Частицы глубоко проникали сквозь электронные оболочки и отклонялись, приближаясь к заряженному ядру. Эти опыты явно свидетельствовали о малых размерах центрального ядра и указали на способ определения ядерного заряда. Резерфорд установил, что альфа-частицы приближаются к центру положительного заряда на расстояние примерно 10-14 м, а это позволило ему сделать вывод, что таков максимально возможный радиус ядра. На основе таких предположений Бор построил свою квантовую теорию атома, успешно объяснившую дискретные спектральные линии, фотоэффект, рентгеновское излучение и периодическую систему элементов. Однако в теории Бора ядро рассматривалось как положительный точечный заряд. Ядра большинства атомов оказались не только очень малы - на них никак не действовали такие средства возбуждения оптических явлений, как дуговой искровой разряд, пламя и т.п. Указанием на наличие некой внутренней структуры ядра явилось открытие в 1896 А. Беккерелем радиоактивности. Оказалось, что уран, а затем и радий, полоний, радон и т.п. испускают не только коротковолновое электромагнитное излучение, рентгеновское излучение и электроны (бета-лучи), но и более тяжелые частицы (альфа-лучи), а они могли исходить лишь из массивной части атома. Резерфорд использовал альфа-частицы радия в своих опытах по рассеянию, которые послужили основой формирования представлений о ядерном атоме. (В то время было известно, что альфа-частицы - это атомы гелия, лишенные своих электронов; но на вопрос - почему некоторые тяжелые атомы спонтанно испускают их, ответа еще не было, как не было и точного представления о размерах ядра.)
Модели ядра
Нач. период развития ядерной физики связан с формированием и развитием капельной и оболочечной моделей ядра. Эти Я. м. возникли почти одновременно в 30-х гг. 20 в. Они основаны на разл. представлениях и призваны описывать противоположные свойства ядер. В капельной модели ядро рассматривается как непрерывная среда, состоящая из нейтронной и протонной жидкостей и описываемая ур-ниями классич. гидродинамики (отсюда др. назв.- г и д р о д и н а м и ч. м о д е л ь). Плотн. ядерной жидкости почти постоянна внутри объёма капли и резко падает в поверхностном слое, толщина к-рого значительно меньше радиуса капли. Осн. параметры: равновесная плотность безграничной ядерной жидкости r 0 (0,16 частиц/Фм 3), энергия связи на 1 нуклон m 0 (16 МэВ) и коэф. поверхностного натяжения s (1 МэВ/Фм 2); иногда вводят s 1 и s 2 для нейтронов и протонов в отдельности. Для учёта зависимости энергии связи ядра от величины нейтронного избытка (N-Z; N и Z- соответственно числа нейтронов и протонов в ядре) вводится изовекторный коэф. сжимаемости ядерной материи b (30 МэВ); для учёта конечной сжимаемости ядерного вещества – изоскалн коэф. сжимаемости (м о д у л ь с ж а т и я) K (200 МэВ).
Капельная модель ядра описывает осн. макроскопич. свойства ядер: свойство насыщения, т. е. пропорциональность энергии связи тяжёлых ядер массовому числу A = N+Z; зависимость радиуса ядра R от A: R = r 0 A 1/3 , где r 0 - практически постоянный коэф. (1,06 Фм) за исключением самых лёгких ядер. Она приводит к Вайцзек-кера формуле, к-рая в среднем хорошо описывает энергии связи ядер. Капельная модель хорошо описывает деление ядер. В сочетании с т. н. оболочечной поправкой (см. ниже) она до сих пор служит осн. инструментом исследования этого процесса.
Оболочечная модель ядра основана на представлении о ядре как о системе нуклонов, независимо движущихся в ср. поле ядра, создаваемом силовым воздействием остальных нуклонов. Эта Я. м. возникла по аналогии с атомной моделью оболочек и первоначально была призвана объяснить обнаруженные экспериментально отклонения от ф-лы Вайцзеккера и существованиемагических ядер, для к-рых N и Z соответствуют наиб. выраженным максимумам энергии связи. В отличие от капельной модели, к-рая практически сразу возникла в законченном виде, оболочечная модель претерпела длит. период поиска оп-тим. формы потенциала ср. поля U(r), обеспечивающего правильные значения магич. чисел. Решающий шаг был сделан в кон. 40-х гг. М. Гёпперт-Майер (М. Goeppert-Mayer) и X. Йенсеном (Н. Jensen), выяснившими важную роль спин-орбитального слагаемого (U SL)ср. поля. Для центр. части ядра в совр. теории обычно используют потенциал Саксона-Вудса.
ЯДЕРНЫЕ РЕАКЦИИ
ЯДЕРНЫЕ РЕАКЦИИ, превращения атомных ядер при взаимодействии с элементарными частицами, g-квантами или друг с другом. Ядерные реакции используются в экспериментальной ядерной физике (исследование свойств элементарных частиц, получение трансурановых элементов и др.), извлечении и применении ядерной энергии и др. Ядерные реакции - основной процесс производства энергии светящихся звезд.
ПОРОГРЕАКЦИИ 
Механизмы ядерных реакций.
По механизму взаимодействия ядерные реакции делятся на два основных вида:
Реакции с образованием составного ядра, это двустадийный процесс, протекающий при не очень
большой кинетической энергии сталкивающихся частиц (примерно до 10 МэВ).
Прямые ядерные реакции, проходящие за ядерное время, необходимое для того, чтобы частица
пересекла ядро. Главным образом такой механизм проявляется при очень больших энергиях бомбардирующих частиц
Бор опубликовал свои результаты в 1913 г. Для мира физики они стали одновременно и сенсацией, и загадкой. Но Англия, Германия и Франция - эти три колыбели новой физики - были вскоре захвачены другой проблемой. Эйнштейн заканчивал работу над созданием новой теории тяготения (одно из следствий ее было проверено в 1919 г. во время международной экспедиции, участники которой измерили отклонение луча света, идущего от звезды, при прохождении его вблизи Солнца во время затмения). Несмотря на огромный успех теории Бора, объяснившей спектр излучения и другие свойства атома водорода, попытки обобщить ее на атом гелия и атомы других элементов оказались мало успешными. И хотя накапливалось все больше сведений о корпускулярном поведении света при его взаимодействии с веществом, очевидная несогласованность постулатов Бора (загадка атома Бора ) оставалась необъясненной.
В двадцатые годы возникло несколько направлений исследований, которые привели к созданию так называемой квантовой теории. Хотя эти направления казались вначале совершенно не связанными между собой, позднее (в 1930 г.) было показано, что все оно эквивалентны и являются просто различными формулировками одной и той же идеи. Проследим за одной из них.
В 1923 г. Луи де Бройль, тогда еще аспирант, выдвинул предположение, что частицы (например, электроны) должны обладать волновыми свойствами. «Мне кажется, - писал он, - …что основная идея квантовой теории состоит в невозможности представить отдельную порцию энергии, не связав с нею определенной частоты».
Объекты волновой природы обнаруживают свойства частиц (например, свет при его излучении или поглощении ведет себя подобно частице). Это было показано Планком и Эйнштейном и использовано Бором в его модели атома. Почему же тогда объекты, которые мы обычно рассматриваем как частицы (скажем, электроны), не могут обнаруживать свойства волн? Действительно, почему? Такая симметрия между волной и частицей была для де Бройля тем же, чем были круговые орбиты для Платона, гармоничные соотношения между целыми числами для Пифагора, правильные геометрические формы для Кеплера или солнечная система, центром которой является светило, для Коперника.
Каковы же эти волновые свойства? Де Бройль предложил следующее. Было известно, что фотон излучается и поглощается в виде дискретных порции, энергия которых связана с частотой формулой:
В то же время соотношение между энергией и импульсом релятивистского кванта света (частицы с нулевой массой покои) имеет вид:
Вместе эти соотношения дают:
Отсюда де Бройль получил связь между длиной волны и импульсом:
для объекта волнового типа - фотона, который, судя по наблюдениям, излучался и поглощался в виде определенных порций.
Далее де Бройль предположил, что со всеми объектами независимо от того, какого они типа - волнового или корпускулярного, связана определенная длина волны, выражающаяся через их импульс точно такой же формулой. Электрону, например, и вообще любой частице соответствует волна, длина волны которой равна:
Что это за волна, де Бройль в то время еще не знал. Однако, если предположить, что электрон в некотором смысле обладает какой-то длиной волны, то мы получим из этого предположения определенные следствия.
Рассмотрим квантовые условия Бора для стационарных орбит электрона. Допустим, что стабильные орбиты таковы, что на их длине укладывается целое число длин волн, т. е. выполняются условия существования стоячих волн. Стоячие волны, будь они на струне или в атоме неподвижны и сохраняют свою форму со временем. При заданных размерах колеблющейся системы они обладают лишь определенными длинами волн.
Предположим, говорил де Бройль, что разрешенными орбитами в атоме водорода являются только те, для которых выполнены условия существования стоячих волн. Для этого на длине орбиты должно укладываться целое число длин волн (фиг. 89), т. е.
nλ = 2πR, n = 1, 2, 3,…. (38.7)
Но связанная с электроном длина волны выражается через его импульс по формуле:
Тогда выражение (38.7) можно записать в виде:
nh/p = 2πR (38.8)
pR = L = nh/2π (38.9)
В результате получается условие квантования Бора. Таким образом, если с электроном связать определенную длину волны, то боровское условие квантования означает, что орбита электрона устойчива, когда на ее длине укладывается целое число стоячих волн. Иными словами, квантовое условие становится теперь не особым свойством атома, а свойством самого электрона (и в конце концов, всех остальных частиц ).
Квантовая природа света. Волновые свойства света, обнаруживаемые в явлениях интерференции и дифракции, и корпускулярные свойства света, проявляющиеся при фотоэффекте и эффекте Комптона, кажутся взаимно исключающими друг друга. Однако такие противоречия существовали лишь в классической физике. Квантовая теория полностью объясняет с единых позиций все свойства света. Характерной чертой квантовой теории света является объяснение всех явлений, в том числе и тех, которые ранее казались объяснимыми лишь с позиций волновой теории. Например, явления интерференции и дифракции света квантовая теория описывает как результат перераспределения фотонов в пространстве.
Распределение фотонов в пучках света при интерференции и дифракции описывается статистическими законами, дающими те же результаты, что и волновая теория. Однако торжество современной квантовой теории в объяснении всех световых явлений не означает, что никаких волн в природе нет.
Волновые свойства электрона. Полному отказу от волновых представлений о природе света препятствуют не только сила традиции, удобство волновой теории и трудность современной квантовой теории. Есть и более серьезная причина. В 1924 г. французский физик Луи де Б рой ль впервые высказал идею, согласно которой одновременное проявление корпускулярных и волновых свойств присуще не только свету, но и любому другому материальному объекту. Эта идея была лишь теоретической гипотезой, так как в то время наука не располагала экспериментальными фактами, которые бы подтверждали существование волновых свойств у элементарных частиц и атомов. В этом заключалось существенное отличие гипотезы де Бройля о волновых свойствах частиц от гипотезы Эйнштейна о существовании фотонов света, выдвинутой им после открытия явления фотоэффекта.
Гипотеза де Бройля существовании волн материи была детально разработана, и полученные из нее следствия могли быть подвергнуты экспериментальной проверке. Основное предположение де Бройля заключалось в том, что любой материальный объект обладает волновыми свойствами и длина волны связана с его импульсом таким же соотношением, каким связаны между собой длина световой волны и импульс фотона. Найдем выражение, связывающее импульс фотона р с длиной волны света. Импульс фотона определяется формулой:
Л. Де Бройль
рис.1 рис.
2
Из уравнения
Е= m с 2 = hv (2)
можно определить массу фотона:
Учитывая это, можно формулу преобразовать так:
Отсюда получаем для длины световой волны формулу:
Если это выражение справедливо, как предположил де Бройль, для любого материального объекта, то длина волны тела массой т, движущегося со скоростью v, может быть найдена так:
Первое экспериментальное подтверждение гипотезы де Брой-ля подучили в 1927 г. независимо друг от друга американские физики К. Д. Дэвиссон и Л. X. Джермер и английский физик Д. П. Томсон. Дэвиссон и Джермер изучали отражение электронных пучков от поверхности кристаллов на установке, схема которой изображена на рисунке 1. Перемещая приемник электронов по дуге окружности, центр которой находится в месте падения электронного пучка на кристалл, они обнаружили сложную зависимость интенсивности отраженного пучка от угла рис. 2. Отражение излучения только под определенными углами означает, что это излучение представляет собой волновой процесс и его избирательное отражение есть результат дифракции на атомах кристаллической решетки. По известным значениям постоянной кристаллической решетки и d угла дифракционного максимума можно по уравнению Вульфа - Брэггов
вычислить длину волны дифрагировавшего
излучения и сопоставить ее с дебройлевской длиной волны
электронов, вы
численной по известному ускоряющему напряжению U:
Вычисленная таким образом из опытных данных длина волны совпала по значению с дебройлевской длиной волны.
Интересны результаты другого опыта, в котором пучок электронов направлялся на монокристалл, но расположение приемника и кристалла не изменялось. При изменении ускоряющего напряжения, т. е. скорости электронов, зависимость силы тока через гальванометр от ускоряющего напряжения имела вид, представленный на рисунке 3. Электронный пучок испытывал наиболее эффективное отражение при скоростях частиц, удовлетворяющих - условию дифракционного максимума.
Последующие эксперименты полностью подтвердили правильность гипотезы де Бройля и возможность использования уравнения (6) для расчета длины волны, связанной с любым материальным объектом. Обнаружена дифракция не только элементарных частиц (электрон, протон, нейтрон), но и атомов.
Выполнив расчеты длины дебройлевской волны для различных материальных объектов, можно понять, почему мы не замечаем в повседневной жизни волновых свойств окружающих нас тел. Их длины волн оказываются столь малыми, что проявление волновых свойств невозможно обнаружить. Так, для пули массой 10 г, движущейся со скоростью 660 м/с, длина дебройлевской волны равна:
Дифракция
электронов на решетке кристалла никеля становится заметной лишь
при таких скоростях движения электронов, при которых их дебройлевская длина
волны становится сравнимой с постоянной решетки.
рис.
3 рис. 4
При этом условии дифракционная картина, получаемая от электронного пучка, становится подобной картине дифракции пучка рентгеновских лучей с такой же длиной волны. На рисунке 4 представлены фотографии дифракционных картин, наблюдающихся при прохождении пучка света (а) и пучка электронов (б) у края экрана.
Гипотеза де Бройля и атом Бора. Гипотеза о волновой природе электрона позволила дать принципиально новое объяснение стационарным состояниям в атомах. Для того чтобы понять это объяснение, выполним сначала расчет длины дебройлевской волны электрона, движущегося по первой разрешенной круговой орбите в атоме водорода. Подставив в уравнение (6) выражение для скорости электрона на первой круговой орбите, получим:
Это значит, что в атоме водорода, находящемся в первом стационарном состоянии, длина дебройлевской волны электрона в точности равна длине его круговой орбиты! Для любой другой орбиты с порядковым номером п получаем:
Этот результат позволяет выразить постулат Бора о стационарных состояниях в такой форме: электрон вращается вокруг ядра неопределенно долго, не излучая энергии, если на его орбите укладывается целое число длин волн де Бройля.
Такая формулировка постулата Бора соединяет в себе одновременно утверждение о наличии у электрона волновых и корпускулярных свойств, отражая его двойственную природу. Соединение волновых и корпускулярных свойств в этом постулате происходит потому, что при расчете длины волны электрона используется модуль скорости, полученный при расчете движения электрона как заряженной частицы по круговой орбите радиуса r.
Взаимные превращения света и вещества. Глубокое единство двух различных форм материи - вещества в виде различных элементарных частиц и электромагнитного поля в виде фотонов - обнаруживается не только в двойственной корпускулярно-волновой природе всех материальных объектов, но главным образом в том, что все известные частицы и фотоны взаимно превращаемы.
Самый известный пример взаимных превращений частиц - это превращение пары электрон - позитрон в два или три гамма-кванта. Этот процесс наблюдается при каждой встрече электрона с позитроном и называется аннигиляцией (т.е. исчезновением). При аннигиляции строго выполняются законы сохранения энергии, импульса, момента импульса и электрического заряда (электрон и позитрон обладают равными зарядами противоположного знака), но материя в форме вещества исчезает, превращаясь в материю в форме электромагнитного излучения.
Процесс, обратный аннигиляции, наблюдается при взаимодействии гамма-квантов с атомными ядрами. Гамма-квант, энергия которого превышает энергию покоя Ео=2m 0 c 2 пары элект рон - позитрон , может превратиться в такую пару.
Ряд экспериментов, проведенных в 10-х – 20-х гг. ХХ в., показали, что частицы, которые привычно представлялись «кирпичиками мироздания», твердыми шариками – корпускулами, - проявляют волновые свойства. Была продемонстрирована дифракция электронов на кристалле, т.е. пучок электронов вел себя аналогично электромагнитной волне. В 1924 г. Луи де Бройль высказал гипотезу о том, что все частицы (а следовательно, и все тела, состоящие из этих частиц) обладают волновыми свойствами. Мерой этих волновых свойств является так называемая длина волны де Бройля . Действительно, сравним квант (фотон) частоты n и длины волны l = с/n и электрон с импульсом р = m e v :
![]() .
.
Значение l Б для обычных тел крайне мало, и их волновые свойства нельзя наблюдать (напомним: для дифракции требовалось, чтобы размер объекта имел порядок l). Именно поэтому в опыте проявляются волновые свойства лишь таких легких частиц, как электрон. Самые крупные объекты, для которых были продемонстрированы волновые свойства – это молекулы фуллерена С 60 и С 70 (масса ~ 10 -24 кг).
Итак, одна из важнейших концепций современности – идея о единстве всех форм материи, и вещества, и поля. Нет принципиальных различий между ними, материя может проявлять себя и как вещество, и как поле. Эта концепция носит название корпускулярно-волнового дуализма (двойственности) материи .
При этом мы вынуждены характеризовать все наблюдаемые величины в терминах классической науки, т.е. на уровне того макромира, в котором существуем сами. Нам трудно вообразить объект, являющийся одновременно и частицей, и волной, поскольку в обыденной жизни мы с такими объектами не встречаемся. Приходится в методологических целях разделять эти понятия. Причины кроются в сложности нашего строения как мыслящих существ. В науке кибернетике показано, что самовоспроизводящаяся система должна обладать высоким уровнем сложности. Мы изучаем микромир как бы извне, будучи неизмеримо сложнее устроены, чем его объекты. Именно и только поэтому дуализм материи не кажется нам очевидным, естественным, присущим ей свойством.
3. Динамика микрочастиц. Принцип неопределенностей Гейзенберга
Если частица проявляет свойства волны, то она как бы размыта в пространстве, представляя собой волновой пакет. В этом случае невозможно говорить о ее координате. Но нельзя ли, например, принять за таковую начало волнового пакета или координату максимума его огибающей?
Оказывается, неопределенность координаты микрочастицы – это фундаментальное свойство микромира, более того, скорость микрочастицы также не поддается точному измерению. Этот факт никак не связан с точностью измерительных приборов.
Действительно, представим себе, что мы пытаемся измерить координату и скорость частицы и используем для этого свет. Минимальное расстояние, которое нам удастся измерить, будет определяться длиной волны этого света, и чем она меньше, тем точнее будет измерение. Но чем меньше длина волны света, тем выше его частота и больше энергия кванта. Квант, обладающий большой энергией, будет взаимодействовать с исследуемой частицей и передаст ей часть своей энергии. Та скорость, которую мы в результате измерим, будет вовсе не искомой первоначальной скоростью частицы, а следствием ее взаимодействия с измерительным прибором. Итак, чем точнее мы измеряем координату, тем меньше точность измерения скорости, и наоборот.
Для волны х р = l E/c = l hn/c =l h/l = h – это максимальная точность.
Формула, выражающая взаимосвязь между неопределенностями нахождения координаты х и импульса р частицы, была получена впервые В.Гейзенбергом и носит его имя:
Dх Dр ³ h –
- принцип неопределенностей Гейзенберга.
Аналогичные соотношения выполняются для неопределенностей Dу и Dz.
Для неопределенностей энергии и времени получается:
Итак, принцип неопределенностей – фундаментальное свойство природы, никак не связанное с несовершенством измерительных приборов, а носящее принципиальный характер.
Принцип неопределенностей, наряду с понятием о квантах, лег в основу новой квантовой механики, идеи и круг задач которой революционным образом отличались от всего известного науке ранее. Произошла ломка научной парадигмы, возник принципиально новый подход к рассмотрению явлений микромира, оказавшийся впоследствии очень плодотворным и в других областях науки.
Опыты по дифракции электронов и других частиц
Важным этапом в создании квантовой механики явилось установление волновых свойств микрочастиц. Идея о волновых свойствах частиц была первоначально высказана как гипотеза французским физиком Луи де Бройлем (1924). Эта гипотеза появилась благодаря следующим предпосылкам.
Гипотеза де Бройля была сформулирована до опытов, подтверждающих волновые свойства частиц. Де Бройль об этом позднее, в 1936 г. писал так: «...не можем ли мы предположить, что и электрон так же двойственен, как и свет? На первый взгляд такая идея казалась очень дерзкой. Ведь мы всегда представляли себе электрон в виде электрически заряженной материальной точки, которая подчиняется законам классической динамики. Электрон никогда не проявлял волновых свойств, таких, скажем, какие проявляет свет в явлениях интерференции и дифракции. Попытка приписать волновые свойства электрону, когда этому нет никаких экспериментальных доказательств, могла выглядеть как ненаучная фантазия».
В физике в течение многих лет господствовала теория, согласно которой свет есть электромагнитная волна. Однако после работ Планка (тепловое излучение), Эйнштейна (фотоэффект) и др. стало очевидным, что свет обладает корпускулярными свойст вами.
Чтобы объяснить некоторые физические явления, необходимо рассматривать свет как поток частиц - фотонов. Корпускулярные свойства света не отвергают, а дополняют его волновые свойства. Итак, фотон - элементарная частица, движущаяся со скоростью света, обладающая волновыми свойствами и име ющая энергию е = hv , где v - частота световой волны.
Выражение для импульса фотона р ф получается из известной формулы Эйнштейна е = тс 2 и соотношений е = hv и р. = тс


 (23.1)
(23.1)
где с - скорость света в вакууме, λ, - длина световой волны. Эта формула была
использована де Бройлем и для других микрочастиц -массой т, движущихся со скоростью и:
р = ти = h/λ откуда
 (23.2)
(23.2)
По де Бройлю, движение частицы, например электрона, описывается волновым
процессом с характеристической длиной волны Я, в соответствии с формулой (23.2). Эти волны
называют вол нами де Бройля.
Гипотеза де Бройля была столь необычной, что многие крупные физики-современники не
придали ей какого-либо значения. Несколькими годами позже эта гипотеза получила экспери-
ментальное подтверждение: была обнаружена дифракция электронов.
Найдем зависимость длины волны электрона от ускоряющего напряжения U электрического
поля, в котором он движется. Изменение кинетической энергии электрона равно работе сил поля:

Выразим отсюда скорость v и, подставив ее в (23.2), получим

Для получения пучка электронов с достаточной энергией, который можно зафиксировать, например, на экране осциллографа, необходимо ускоряющее напряжение порядка 1 кВ. В этом случае из (23.3) находим Я, = 0,4 10~ 10 м, что соответствует длине волны рентгеновского излучения.
Дифракция рентгеновских лучей наблюдается на кристаллических телах; следовательно, для дифракции электронов необходимо также использовать кристаллы.
К. Дэвиссон и Л. Джермер впервые наблюдали дифракцию электронов на монокристалле никеля, Дж. П. Томсон и независимо от него П. С. Тартаковский - на металлической фольге (поликристаллическое тело). На рис. 23.1 изображена электронограм-ма - дифракционная картина, полученная от взаимодействия электронов с поликристаллической фольгой. Сравнивая этот рисунок с рис. 19.21, можно заметить сходство дифракции электронов и рентгеновских лучей.
Способностью дифрагировать обладают и другие частицы, как заряженные (протоны, ионы и др.), так и нейтральные (нейтроны, атомы, молекулы).
Аналогично рентгеноструктурному анализу можно применять дифракцию частиц для оценки степени упорядоченности расположения атомов и молекул вещества, а также для измерения параметров кристаллических решеток. В настоящее время широкое распространение имеют методы электронографии (дифракция электронов) и нейтронографии (дифракция нейтронов).
Может возникнуть вопрос: что происходит с отдельными частицами, как образуются максимумы и минимумы при дифракции отдельных частиц?

Электронный микроскоп.
Понятие об электронной оптике
Волновые свойства частиц можно использовать не только для дифракционного структурного анализа, но и для получения увеличенных изображений предмета.
Открытие волновых свойств электрона сделало возможным создание электронного микроскопа. Предел разрешения оптического микроскопа (21.19) определяется в основном наименьшим значением длины волны света, воспринимаемого глазом человека. Подставив в эту формулу значение длины волны де Бройля (23.3), найдем предел разрешения электронного микроскопа, в котором изображение предмета формируется электронными пучками:

Видно, что предел разрешения г электронного микроскопа зависит от ускоряющего напряжения U , увеличивая которое можно добиться, чтобы предел разрешения был значительно меньше, а разрешающая способность значительно больше, чем у оптического микроскопа.
Электронный микроскоп и его отдельные элементы по своему назначению подобны оптическому, поэтому воспользуемся аналогией с оптикой для объяснения его устройства и принципа действия. Схемы обоих микроскопов изображены на рис. 23.2 (а - оптический; б - электронный).
В оптическом микроскопе носителями информации о предмете АВ являются фотоны, свет. Источником света обычно служит лампа накаливания 1 . После взаимодействия с предметом (поглощение, рассеяние, дифракция) поток фотонов преобразуется и содержит информацию о предмете. Поток фотонов формируется с помощью линз: конденсора 3, объектива 4, окуляра 5. Изображение AjBj регистрируется глазом 7 (или фотопластинкой, фотолю-минесцирующим экраном и т. д.).
В электронном микроскопе носителем информации об образце являются электроны, а их источником - подогреваемый катод 1. Ускорение электронов и образование пучка осуществляется фокусирующим электродом и анодом - системой, называемой электронной пушкой 2. После взаимодействия с образцом (в основном рассеяние) поток электронов преобразуется и содержит информацию об образце. Формирование потока электронов происходит

под воздействием электрического поля (система электродов и конденсаторов) и магнитного (система катушек с током). Эти системы называют электронными линзами по аналогии с оптическими линзами, которые формируют световой поток (3 - конденсорная; 4 - электронная, служащая объективом; 5 - проекционная). Изображение регистрируется на чувствительной к электронам фотопластинке или катодолюминесцирующем экране 6.
Чтобы оценить предел разрешения электронного микроскопа, подставим в формулу (23.4) ускоряющее напряжение U = 100 кВ и угловую апертуру и порядка 10 2 рад (приблизительно такие углы используют в электронной микроскопии). Получим г ~ 0,1 нм; это в сотни раз лучше, чем у оптических микроскопов. Применение ускоряющего напряжения, большего 100 кВ, хотя и повышает разрешающую способность, но сопряжено с техническими сложностями, в частности происходит разрушение исследуемого объекта электронами, имеющими большую скорость. Для биологических тканей из-за проблем, связанных с приготовлением образца, а также с его возможным радиационным повреждением, предел разрешения составляет около 2 нм. Этого достаточно, что-
бы увидеть отдельные молекулы. На рис. 23.3 показаны нити белка актина, имеющие диаметр примерно 6 нм. Видно, что они состоят из двух спирально закрученных цепей молекул белка.
Укажем некоторые особенности эксплуатации электронного микроскопа. В тех частях его, где пролетают электроны, должен быть вакуум, так как в противном случае столкновение электронов с молекулами воздуха (газа) приведет к искажению изображения. Это требование к электронной микроскопии усложняет процедуру исследования, делает аппаратуру более громоздкой и дорогой. Вакуум искажает нативные свойства биологических объектов, а в ряде случаев разрушает или деформирует их.
Для рассматривания в электронном микроскопе пригодны очень тонкие срезы (толщина менее 0,1 мкм), так как электроны сильно поглощаются и рассеиваются веществом.
Для исследования поверхностной геометрической структуры клеток, вирусов и других микрообъектов делают отпечаток их поверхности на тонком слое пластмассы (реплику). Обычно предварительно на реплику в вакууме напыляют под скользящим (малым к поверхности) углом слой сильно рассеивающего электроны тяжелого металла (например, платины), оттеняющий выступы и впадины геометрического рельефа.
К достоинствам электронного микроскопа следует отнести большую разрешающую способность, позволяющую рассматривать крупные молекулы, возможность изменять при необходимости ускоряющее напряжение и, следовательно, предел разрешения, а также сравнительно удобное управление потоком электронов с помощью магнитных и электрических полей.

Наличие волновых и корпускулярных свойств как у фотонов, так и у электронов и других частиц, позвол яет ряд положений и
законов оптики распространить и на описание движения заряженных частиц в электрических и магнитных полях.
Эта аналогия позволила выделить как самостоятельный раздел электронную оптику - область физики, в которой изучается структура пучков заряженных частиц, взаимодействующих с электрическими и магнитными полями. Как и обычную оптику, электронную можно подразделить на геометрическую (лучевую) и волновую (физическую).
В рамках геометрической электронной оптики возможно, в частности, описание движения заряженных частиц в электрическом и магнитном полях, а также схематическое построение изображения в электронном микроскопе (см. рис. 23.2, б).
Подход волновой электронной оптики важен в том случае, когда проявляются волновые свойства заряженных частиц. Хорошей иллюстрацией этому является нахождение разрешающей способности (предела разрешения) электронного микроскопа, приведенное в начале параграфа